Aufgabenstellung
Die am FILK erfolgreich durchgeführte Technik der thermoplastischen Verarbeitung von Kollagen sollte auf Proteine pflanzlicher Herkunft erweitert werden. Pflanzenproteine fallen häufig als Nebenprodukte in industriellen Prozessen (z. B. Bioethanol- oder Ölgewinnung aus Weizen, Raps, Soja o. ä.) an und sind kommerziell relativ kostengünstig und in großen Mengen erhältlich. Als auf nachwachsenden Rohstoffen basierende Biopolymere eignen sie sich für einen Einsatz als Rohmaterial für Biokunststoffe. Neben Stärke, Polylactid und Polyestern sind Proteine in diesem Sektor bislang kaum vertreten. Mögliche Anwendungen für proteinbasierte Produkte liegen im Verpackungsbereich (Lebensmittel und Non-Food), im landwirtschaftlichen oder im medizinisch-pharmazeutischen Sektor.
Projektziel
Ziel des Forschungsprojekts war die Entwicklung eines Verfahrens zur thermoplastischen Verarbeitung kommerzieller Pflanzenproteinisolate. Basierend auf dem am FILK etablierten Prozess der Extrusion von Thermoplastischem Kollagen sollten die technologischen Parameter an die pflanzlichen Rohstoffe angepasst und optimiert, sowie die resultierenden Produkte analytisch charakterisiert werden. Derart hergestellte Folien aus Pflanzenproteinen sollten in einem weiteren Prozessschritt durch Kombination mit flexiblen Trägermaterialien zu Verbundmaterialien verarbeitet werden.
Lösungsweg
Als Rohmaterial dienten kommerziell erhältliche Pflanzenproteinisolate mit einem Proteingehalt von mindestens 70 % (TS), und zwar vitales und hydrolysiertes Weizengluten, zwei sich im pH-Wert unterscheidende Sojaproteinisolate, sowie Erbsenproteinisolat. Neben Proteinen enthalten diese Kohlenhydrate, Fette, Mineralstoffe und Wasser in wechselnden Mengen (Tab. 1). Zur thermoplastischen Verarbeitung wurden Wasser und Glycerin als Weichmacher zugesetzt. In Vorversuchen am Laborinnenmischer („Kneter“) wurden die technologischen Verarbeitungsgrenzen bezüglich Wasser- und Glyceringehalt und Temperatur ermittelt. Nach Übertragung auf den Extrusionsprozess wurden die Parameter angepasst und optimiert. Die so hergestellten thermoplastischen Granulate aus Pflanzenproteinen wurden analytisch charakterisiert und die Werte mit denen der Rohproteine verglichen, um Einflüsse des technologischen Prozesses zu beurteilen. Schließlich wurden Folienproben mithilfe einer Plattenpresse hergestellt, um die mechanischen und Barriereeigenschaften von Proteinfolien zu ermitteln. Die Kombination von Proteinfolien und Trägermaterialien konnte aufgrund technischer Schwierigkeiten im Rahmen dieses Projekts nicht realisiert werden.
Ergebnisse
Thermoplastische Verarbeitung von Pflanzenproteinen
Versuche mit verschiedenen Rezepturen aus Protein, Wasser und Glycerin am Laborinnenmischer und Extruder ergaben, dass Pflanzenproteine ohne Wasserzusatz mit Glycerin als Weichmacher bei Temperaturen oberhalb 140 °C thermoplastisch verarbeitet werden können. Damit unterscheiden sie sich deutlich von Thermoplastischem Kollagen, welches einen hohen Wasseranteil und geringere Temperaturen erfordert. Die im Proteinisolat vorliegenden Nebenbestandteile, wie Kohlenhydrate und Fette, stören offenbar den Plastifizierungsprozess nicht, so dass die kommerziell erhältlichen Isolate direkt eingesetzt werden können und keine weitere Aufreinigung erfordern. Die exakte Protein-Glycerin-Rezeptur, sowie die technischen Parameter der Extrusion (Schneckendrehzahl, Dosierungsgeschwindigkeit, Temperatur, Düsengeometrie) müssen für jeden Proteintyp individuell ermittelt werden. Die optimierten Daten sind dann aber auf gleichartige Proteinisolate anderer Hersteller übertragbar. Eine Ausnahme unter den untersuchten Pflanzenproteinen bildete hydrolysiertes Weizengluten. Hier war kein stabiler Extrusionsprozess möglich. Durch ungünstige Teigbildung kam es zu Schwankungen der Zusammensetzung während der Extrusion, und es bildete sich kein einheitliches Extrudat. Offenbar ist hier das Protein durch die hydrolytische Vorbehandlung bereits zu stark abgebaut. Von weiteren Untersuchungen an hydrolysiertem Weizengluten wurde daher abgesehen. Die Extrusionstemperatur spielt eine wichtige Rolle, die Plastifizierung der Proteine und ein gleichmäßiger Schmelzfluss sind jeweils nur in einem kleinen Temperaturfenster möglich, wie in Abb. 1 am Beispiel von Weizengluten zu erkennen ist. Einen großen Einfluss hat auch die Düsengeometrie. Abb. 2 zeigt thermoplastische Pflanzenproteingranulate, die aus dünnen Strängen gewonnen wurden, die durch Extrusion mithilfe einer Lochdüse hergestellt wurden. Dagegen gelang die Extrusion von Bändern durch Schlitzdüsen nur in wenigen Fällen. Die geringe Reißfestigkeit der Extrudatoberfläche führt dazu, dass schon kleine Unebenheiten den Schmelzfluss stören und die Herstellung gleichmäßiger Bänder behindern. Aus den gleichen Gründen war es bisher nicht möglich, großflächige Folien durch Kalandrieren oder Folienblasen herzustellen.
Charakterisierung der Extrudate
Rheologie der Proteinschmelze
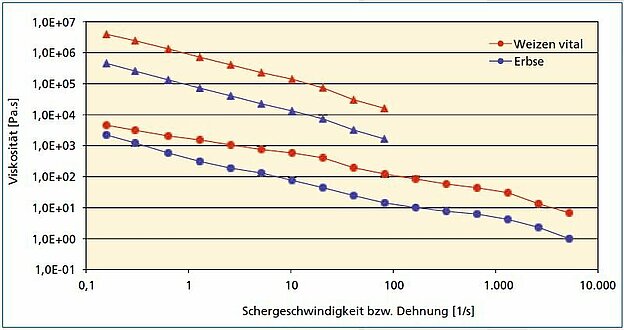
Durch Verwendung einer Dehndüse am Extruderausgang wurden über Druckmessungen die Scher- und Dehnviskositäten der Proteinschmelzen unter Extrusionsbedingungen ermittelt. Abb. 3 zeigt in doppeltlogarithmischer Auftragung beispielhaft die Abhängigkeit der Viskositäten von der Scherrate bzw. Dehnung für vitales Weizengluten und Erbsenprotein. Die Kurven weisen für alle Proteine die für Thermoplasten typische lineare Abnahme auf, so dass Pflanzenproteine unter diesen Bedingungen als thermoplastisches Material bezeichnet werden können. Daneben sind individuelle Unterschiede zwischen den Proteintypen erkennbar. So ist z. B. Weizengluten deutlich höher viskos als Erbsenprotein.
Zusammensetzung und Löslichkeit
Tab. 2 zeigt die Zusammensetzung der Proteinrezepturen bezüglich Wasser-, Protein- und Fettgehalt sowie ihre Warmwasserlöslichkeit nach der Extrusion. Für einen Vergleich mit den entsprechenden Daten der Rohproteine (Tab. 1) muss beachtet werden, dass der Glycerinanteil in die Trockensubstanz mit eingeht. Es ist festzustellen, dass sich die Zusammensetzung durch den technischen Prozess nicht signifikant ändert. Der tatsächliche Gehalt an Glycerin (ermittelt durch den Vergleich der Proteingehalte von Granulat und Rohprotein) ist leicht geringer als die in der Rezeptur eingesetzte Menge, was auf teilweise Verdampfung während der Extrusion zurückzuführen ist. Eine Ausnahme bildet hydrolisiertes Weizengluten. Aufgrund des instabilen Extrusionsprozesses und des schwankenden Protein-Glycerin-Verhältnisses weist das zur Analyse ausgewählte Extrudat eine zufällige Zusammensetzung auf, die nicht der eingesetzten Rezeptur entspricht. Unter der Annahme, dass Glycerin sich in Wasser vollständig löst, ist allerdings die Wasserlöslichkeit der Extrudate geringer, als ausgehend von der Löslichkeit der Rohproteine zu erwarten wäre. Dies lässt den Rückschluss zu, dass auf molekularer Ebene Veränderungen aufgetreten sind, die sich nicht in der Zusammensetzung widerspiegeln.
Maillard-Verbindungen
Einflüsse des Extrusionsprozesses auf das Material machen sich während der Extrusion qualitativ durch Geruchsentwicklung (z. B. brotartig bei Weizen) und Farbveränderung bemerkbar. Die deutliche Braunfärbung der Extrudate (s. Abb. 2) bei den verwendeten Extrusionstemperaturen ist vermutlich auf Maillard-Reaktionen zwischen Proteinen und Kohlenhydraten zurückzuführen. Die entstehenden Verbindungen stellen eine Mischung unterschiedlichster Substanzen dar, die sich in ihrer Gesamtheit durch Fluoreszenz bei 360 und 460 nm nachweisen lassen. Ein Vergleich der Fluoreszenzwerte der Extrudate mit denen der Rohproteine zeigt in der Tat einen mit dem optischen Eindruck konformen starken Anstieg bei Weizen (um das 3,5 bis 4-fache), während Soja (1,2-fach) und Erbse (1,1-fach) geringer beeinflusst werden.
Aminosäureprofil
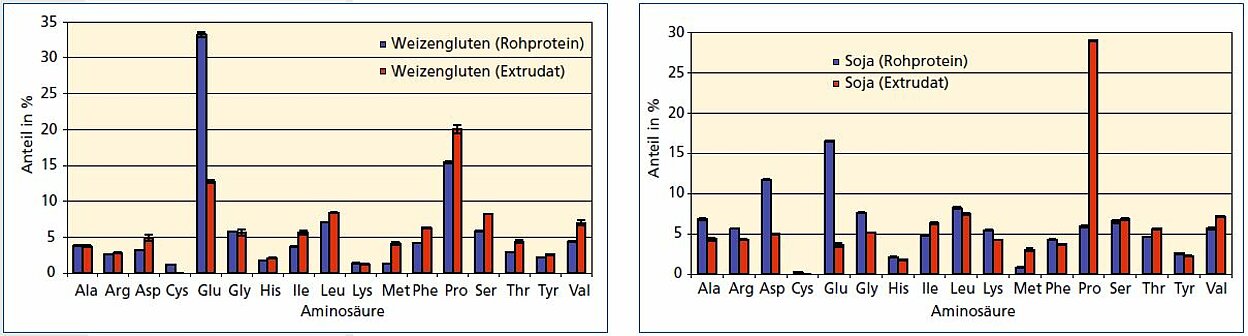
Deutliche Veränderungen der Proteine durch die Extrusion sind in der Aminosäurezusammensetzung zu erkennen, die für Rohproteine und Granulate mithilfe eines automatischen Aminosäureanalysators ermittelt wurde. Abb. 4 zeigt die prozentuale Zusammensetzung für Weizen und Soja vor und nach der Extrusion, wobei methodenbedingt Asn und Asp, sowie Gln und Glu nicht unterschieden werden und Trp nicht detektiert wird. Während sich der Anteil der Mehrzahl der Aminosäuren nur marginal ändert, sind für beide Proteintypen gewisse Aminosäuren zu identifizieren, deren Gehalt drastisch zu- oder abnimmt. So sinkt bei Weizengluten der Glutamatgehalt auf fast ein Drittel ab, während der Methioninanteil um das Dreifache ansteigt. Bei Soja sind es die Aminosäuren Aspartat bzw. Glutamat, die eine starke Abnahme, und Methionin bzw. Prolin, die eine starke Zunahme zeigen. Erbsenprotein ist in seinem Aminosäureprofil mit Sojaprotein zu vergleichen. Die genaue Art dieser Veränderungen ist nicht bekannt und erfordert weiter gehende Untersuchungen.
Verhalten gegenüber Wasserdampf
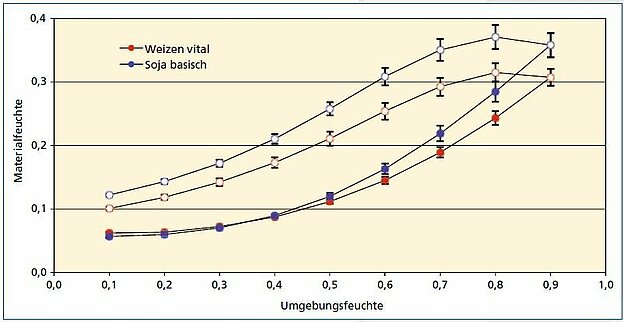
Die Untersuchung der Abhängigkeit der Materialfeuchte der Extrudate von der Umgebungsfeuchte in Form von Sorptions- und Desorptionsisothermen zeigt in allen Fällen eine deutliche Hysterese (s. Abb. 5), die vermutlich auf den hohen Anteil hygroskopischen Glycerins zurückzuführen ist. Diese Eigenschaft kann bei geplanten Anwendungen von Proteinfolien z. B. als Verpackungsmaterial eine Rolle spielen. Die Wasserdampfdurchlässigkeit von Folienproben aus Weizengluten und Sojaprotein wurde bei 23 °C mit einem Feuchtegradienten von 50 zu 100 % untersucht. Tab. 3 zeigt die ermittelten Werte. Erwartungsgemäß fallen die Durchlässigkeiten der hydrophilen Folien relativ hoch aus. Der Vergleich mit Werten, wie sie für Polyethylen (2 – 20 g/d·m2) oder Polylactid (53 g/d·m2) berichtet werden, zeigt, dass hier vor einer praktischen Anwendung noch erheblicher Optimierungsbedarf besteht.
Mechanische Festigkeit
Zur Beurteilung der mechanischen Belastbarkeit von Proteinfolien wurden Zugfestigkeitstests an Folienproben aus Weizengluten und Sojaprotein durchgeführt (Normklima, Belastung bis zum Bruch). Die Werte, die in Tab. 3 aufgeführt sind, sind im Vergleich zu kommerziellen Polymerfolien, wie Polyethylen (ca. 32 N/mm2) oder Polylactid (> 13 N/mm2), relativ niedrig. Auch hier ist weiterer Optimierungsbedarf gegeben.
ZUSAMMENFASSUNG
Im Ergebnis liefert das Projekt eine Verarbeitungsvorschrift, um kommerziell erhältliche Pflanzenproteinisolate ohne weitere Aufreinigung unter Zusatz von Glycerin als Weichmacher thermoplastisch in einem Extruder zu verarbeiten. Dabei haben sich vitales Weizengluten sowie Sojaprotein als geeignete Kandidaten herausgestellt. Sowohl hydrolysiertes Weizengluten als auch Erbsenprotein sind aufgrund ihrer Verarbeitungseigenschaften für die technische Verwendung weniger geeignet. Ersteres lässt sich im Extrusionsprozess nicht kontinuierlich und homogen umsetzen, während letzteres einen sehr hohen Glycerinanteil erfordert, der die Herstellung von Folien durch zu hohe Weichheit verhindert und bei Lagerung aus dem Extrudat migriert. Veränderungen der Proteine während der Extrusion (Farbe, Aminosäureprofil) spiegeln die unterschiedlichen Proteintypen wider. Weizen (hochmolekulare, disulfidverbrückte Prolamine) und Soja (weniger komplexe Globuline) verhalten sich unterschiedlich. Die Materialeigenschaften der Extrudate und aus ihnen hergestellter Folien (Zugfestigkeit, Löslichkeit, Wasserdampfdurchlässigkeit und –absorption) können bislang nicht mit handelsüblichen Polymeren konkurrieren. Auch die angestrebte Kombination von Proteinfolien mit flexiblen Trägern konnte aufgrund technischer Schwierigkeiten bei der Herstellung großflächiger Folien nicht realisiert werden. Hier ist weiterer Forschungsbedarf vorhanden.

Danksagung
Das IGF-Vorhaben (VF-Nr. 15897 BR) der Forschungsvereinigung „Verein zur Förderung des Forschungsinstitutes für Leder und Kunststoffbahnen (FILK) Freiberg/Sachsen e. V.“ wurde über die AiF im Rahmen des Programms zur Förderung der „Industriellen Gemeinschaftsforschung und -entwicklung (IGF)“ vom Bundesministerium für Wirtschaft und Technologie (BMWi) aufgrund eines Beschlusses des Deutschen Bundestages gefördert. Wir bedanken uns für die gewährte Unterstützung.