Ausgangssituation
Kollagene sind Proteine der extrazellulären Matrix, die in allen vielzelligen Tieren für die Ausbildung von Gewebestrukturen verantwortlich sind. Sie sind vor allem ein bedeutender Bestandteil des Bindegewebes (z. B. in Haut, Sehnen, Bändern und Knorpel). Kollagen wird in der Medizin, in der Lebensmittelindustrie und in der Kosmetik seit langem genutzt. Dazu wird es aus tierischen Geweben, wie Haut oder Sehne gewonnen. Die Isolation aus dem Rohmaterial ist aufwendig und die Qualität unterliegt natürlichen Schwankungen.
Für viele Anwendungen ist es nicht erforderlich, komplette Kollagenproteine einzusetzen. Daher sind einzelne Peptide, wie sie z. B. in bakteriellen Proteinen mit Kollagendomänen (Bakterienkollagen) zu finden sind, eine gute Alternative. Solche Proteine sind daher interessante Ausgangsmaterialien für die Entwicklung neuer Biomaterialien. Voraussetzung ist, dass die Peptide in großen Mengen hergestellt werden können. Eine Möglichkeit ist die biotechnologische Herstellung dieser Proteine mit gentechnisch veränderten Organismen. Scl2 ist ein bakterielles Protein mit Kollagendomäne und wird im Mikroorganismus Streptococcus pyogenes exprimiert.
Projektziel
Ziel des Projektes war die Entwicklung von Verfahren für die Gewinnung des Bakterienkollagens scl1 mit den für biotechnologische Anwendungen häufig genutzten Organismen Bacillus subtilis und Escherichia coli. Das sc/1-Gen mit Sequenzen für Signalpeptide sollte in Expressionsplasmide kloniert und anschließend in B. subtilis- und E. coli-Zellen transformiert werden.
Lösungsweg
Das Protein wurde mit Sekretionssignalen versehen, damit es von den Zellen ins extrazelluläre Medium abgegeben wird. Die Sekretion eines Proteins ermöglicht nicht nur höhere Ausbeuten, sondern auch eine einfache Aufreinigung des Proteins aus dem Medium nach Abtrennen der Zellen. Da es zwischen B. subtilis und E. coli Unterschiede in der Zellmorphologie und der Proteinsekretion gibt, sollten Expression und Sekretion von scl1 in den beiden Spezies untersucht werden.
Das Gen und die Signalpeptidsequenzen wurden zunächst in PeR-Reaktionen amplifiziert. Die PeR-Primer waren mit Überhängen versehen worden, um Gen und Signalpeptid in einer Fusions-PCR zu verbinden. Nachdem die Fusions-PeRs nicht erfolgreich waren, wurde sc/1 mit neuen Primern (Megaprimern) amplifiziert, wobei der Forward-Primer die Sequenz des Signalpeptids enthielt. Die PCR mit den Megaprimern war für alle ausgewählten B. subtilis-Signalpeptide, aber nur für ein E. co/i-Signalpeptid erfolgreich. Anschließend sollten die PCR-Produkte (sc/1 mit Signalpeptid} in die Expressionsplasmide integriert werden. Für B. subtilis wurde pHT01 gewählt. Das PCR-Produkt und das Plasmid wurden mit den gleichen Restriktionsenzymen geschnitten. Dabei bilden sich überhängende Enden, die zueinander passen und in einer folgenden Ligation enzymatisch verbunden werden.
Leider konnten auf diese Weise keine Expressionsplasmide hergestellt werden. Für E. coli wurde das Plasmid pDEST14 genutzt. Das Plasmid ist für die sogenannte Gateway-Technologie zur Klonierung von Genen optimiert. Sie basiert auf dem Rekombinationssystem des Phagen A. (einem Bakterienvirus}, der seine DNA in das E. coli-Genom integriert. Dazu werden spezifische Erkennungssequenzen benötigt, die attbStellen genannt werden.
Ergebnisse | Nutzen
Mit der Gateway-Kionierung konnte keine Integration des sc/1-Gens mit Signalpeptid in das Plasmid erreicht werden. Sowohl für B. subtilis als auch für E. co/i wurden alternative Klonierungsstrategien (AQUA- und ABe-Kionierung) genutzt, die aber ebenfalls nicht zu einer erfolgreichen Integration von sc/1 mit Signalpeptid in die Plasmide führten.
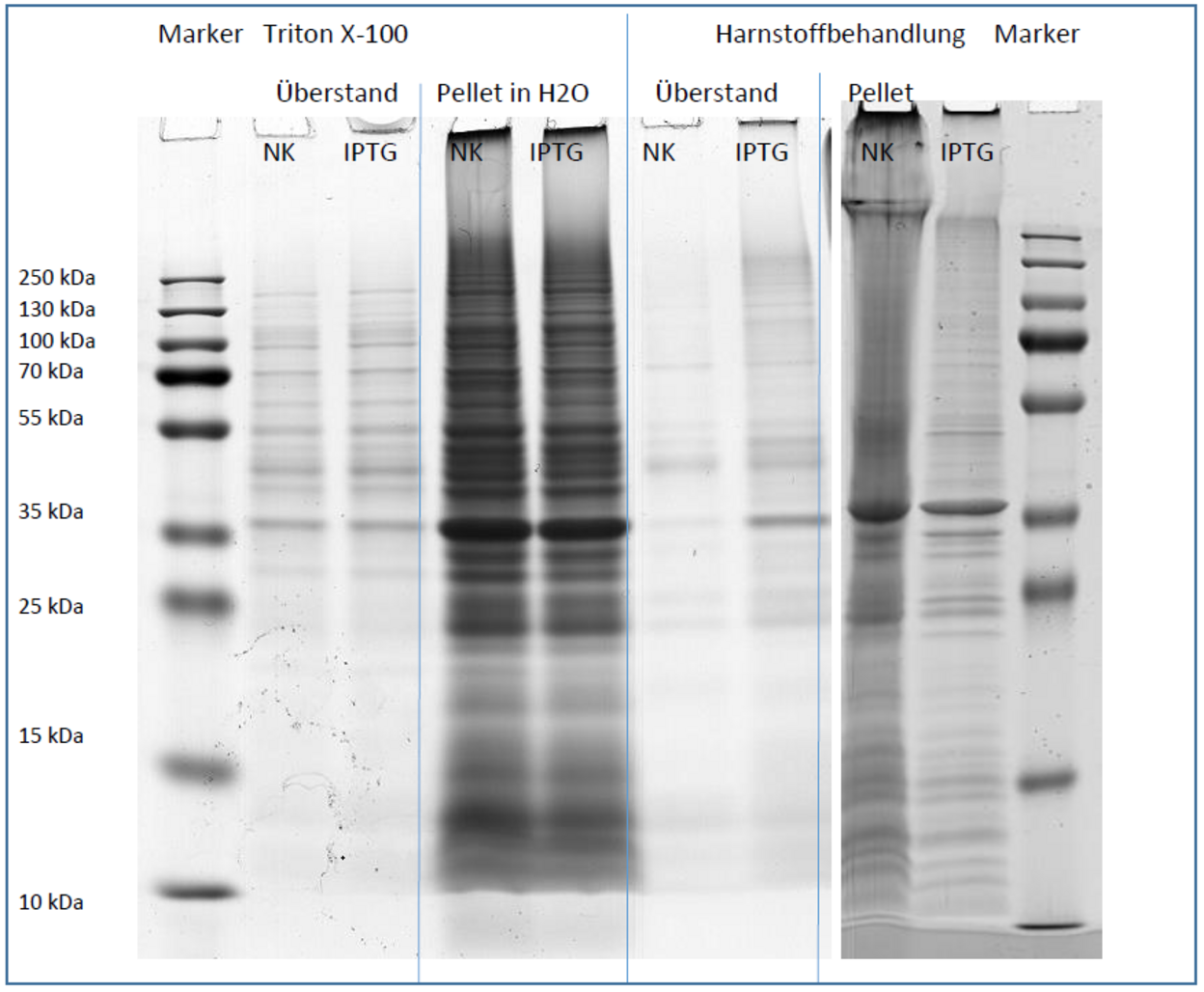
Für die Klonierung wurde eine Firma beauftragt, die das Gen (mit Signalpeptid} synthetisierte und es in die Plasmide (pHT01 für B. subtilis und pET-40b(+) für E. coli) integrierte. Für B. subtilis wurde das Signalpeptid des Proteins Pectatlyase (Pel) genutzt. Plasmid pET-40b(+) enthält bereits das Signalpeptid der periplasmatischen Proteindisulfidisomerase (DsbA). B. subtilis und E. coli konnten erfolgreich mit den Plasmiden transformiert werden. Das Vorhandensein der Plasmide konnte für beide Stämme nach einer Plasmidisolation nachgewiesen werden. Anschließend wurden beide plasmidtragenden Stämme kultiviert und Protein gewonnen. Die Synthese von scl1 wurde während des Wachstums durch Zugabe von IPTG induziert. Für B. subtilis wurden zelluläre und sekretierte Proteine analysiert. Da E. coli bei hoher Proteinsyntheserate sogenannte lnclusion Bodies bilden kann, in denen sich denaturierte Proteine anreichern, wurden diese zusätzlich untersucht.
Für B. subtilis konnte keine Expression von scl1 nachgewiesen werden. ln den Proteinextrakten von E. coli wurden Proteine gefunden, die erst nach Induktion mit IPTG auftreten. Bisher konnten diese Proteine aber nicht analysiert werden, um nachzuweisen, dass es sich um scl1 handelt.
Dank
Das Forschungsvorhaben Reg.-Nr.: 49VF200021 „Verfahren zur Sekretion kollagenähnlicher Proteine“ wurde anteilig vom Bundesministerium für Wirtschaft und Klimaschutz (BMWK) aufgrund eines Beschlusses des Deutschen Bundestages innerhalb des Förderprogramms „FuE-Förderung gemeinnütziger externer Industrieforschungseinrichtungen – Innovationskompetenz (INNO-KOM) – Modul Vorlaufforschung (VF)“ über den Projektträger EuroNorm GmbH gefördert. Wir bedanken uns für die gewährte Unterstützung.